therapeutic drug monitoring(TDM)概論(3/3)
最終回はアミノグリコシド系抗菌薬と、抗真菌薬ボリコナゾールについて概論していく。
アミノグリコシド(Aminoglycosides;AGs)
1.投与法
AGsの投与法には、複数回分割投与法(multiple daily dosing;MDD)と、PK/PD理論を生かした1日1回投与法(once-daily dosing;OD)がある(表1)。ODについては、高濃度ピークにより抗菌効果が向上するほか、腎毒性の減少、コスト削減など多方面で有効性が示されている[1]。
感染性心内膜炎(infective endocarditis;IE)に対してゲンタマイシン(Gentamicin;GM)をシナジー効果を期待して併用する場合は、3mg/kg/日を2~3回に分割して投与する。近年、連鎖球菌のIEについてはODでも有効であることが報告され[2]、米国心臓協会(American Heart Association;AHA)や欧州心臓病学会(European Society of Cardiology;ESC)のガイドラインでも推奨されている。
2.renal dosing
AGsは、どれも90%以上が腎臓から排泄される腎排泄性薬剤である。renal dosingについては、1回量を減量するSanfordガイドや、投与間隔を延長するHartfordレジメン[3]が有名である。2000年のアメリカでの調査では、74.7%の施設で投与間隔延長法を採用している[4]。いずれもTDMを行なうべきであり、感染症専門医や薬剤師などと相談することが望ましい。
3.TDM
AGsは、トラフ値および投与開始1時間後のピーク値がTDMの指標である(表1)。半減期が数時間と短いので、投与開始翌日には評価可能である。
一般に、ピーク値は「効果の指標」、トラフ値は「毒性の指標」と認識されている。Cmax/MICが抗菌効果と関連しており、毒性のない範囲でピークを高くすることにより、高い効果を得ることができる。しかし、ピーク値については、臨床的エビデンスに基づく明確な目標値ではなく参考値であることを念頭に置くべきだろう。
AGsの毒性としては腎毒性と聴覚毒性が有名であり、血中濃度との関連が深いことが知られている。
腎毒性は、高いトラフ値(GM>2mg/L、アミカシン(Amikacin;AMK)>10mg/L)が持続すると危険性が高まり[5]、トラフ値を十分に低下させることで軽減できることが報告されている。
聴覚毒性についても血中濃度との関連が示唆されているが、血中濃度以外にもリスクファクターが知られており(表2)[6]、TDMだけでマネジメントするには限界がある。しかし、TDM導入によるメリットが示されていること[1]、および聴覚毒性のリスクファスターを可能な限り排除する観点からTDMを実施する意義はあると考える。
表1 summary of Aminoglycosides TDM
採血時期:2日目以降
採血時刻:ピーク値(点滴開始1時間後)およびトラフ値
開始時投与量および目標血中濃度:
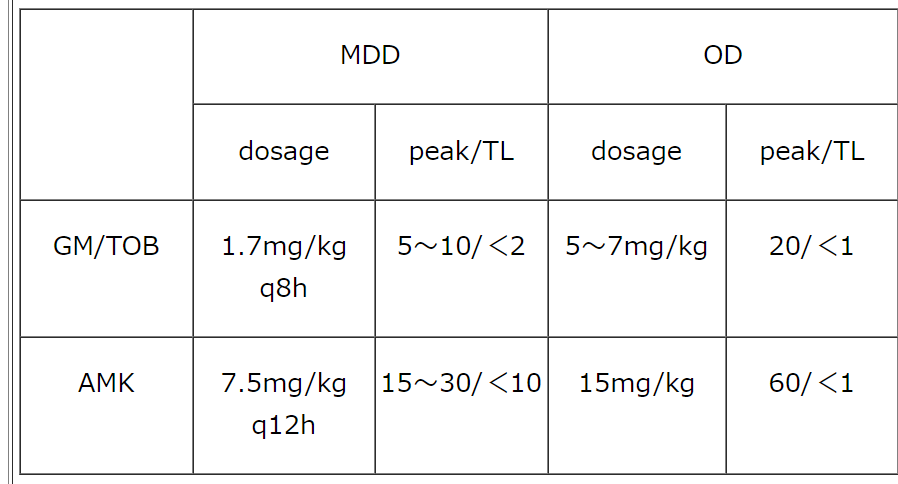
表2 risk factor of AGs induced ototoxicity (文献6より引用)
| ・高い血中濃度(ピーク、トラフ) ・1日投与量 ・累積投与量 ・AGs曝露歴 ・投与期間 ・腎機能低下者 ・高齢 ・脱水 ・他の聴覚毒性薬物の併用 ・遺伝子多型 |
4.症 例
86歳女性、E.faecalis 感染性心内膜炎、eGFR49mL/分、34kg
アンピシリンに併用してGM1mg/kg≒30mgを8時間ごとで開始
ピーク:4.2mg/L、トラフ:2.0mg/L
→トラフが下がりきっていないことから、8時間ごとから12時間ごとへ減量
ボリコナゾール(Voriconazole;VRCZ)
今回取り上げた、TDMが必要な薬剤の中で唯一、肝代謝型の薬剤である。薬物代謝酵素CYP(cytochromeP450)で代謝される薬剤であることから、カルシニューリン阻害薬をはじめとして薬物相互作用に注意が必要である。また、日本人を含むアジア人はCYP2C9のpoor metabolizerの割合が多いことが知られている[7]。このことは用量調節に影響を与えるリスクファクターであるが、遺伝子多型のみで投与量を調節すべきではなく、TDMで確認しながら行なうべきである[8]。
1.投与法(表3)
維持量は3~4mg/kg/日であるが、前述のように日本人は過量となりやすい集団であるため、3mg/kg/日で開始するなど初期投与量設定に注意が必要である。
肝不全症例であっても、Child-Pugh分類でA以下となるまで減量は不要であるが、TDMを行ないながら慎重に投与していくべきである。eGFR<30mL/分の場合、添加物であるスルホブチルエーテルβ-シクロデキストリンナトリウムが蓄積してしまうことから注射薬は原則として避け、経口薬を用いる[9]。バイオアベイラビリティは96%と良好であるが、高脂肪食で吸収が22%低下するので、食前1時間または食後2時間の空腹時に投与する[10]。
2.TDM
VRCZの代謝は用量依存性に変化する。半減期は6~24時間の間でばらつきが大きいため、TDMは投与開始5~7日以降のトラフ値を測定する。
トラフ値を1ないし2mg/L以上にすることで、治療成功率の向上が認められている[11、12]。また、トラフ値が4mg/Lを超えると肝障害や視力障害が増加することが報告されている[11、12]。有害事象については、いずれも可逆的であることが多い。
表3 summary of Voriconazole TDM
| 開始時投与量 | 6mg/kg を12時間ごと、以後3~4mg/kg を12 時間ごと |
| 採血時期 | 5~7日後 |
| 採血時刻 | トラフ値 |
| 目標血中濃度 | 1~2mg/L 以上、4mg/L 以下 |
3.症 例
60歳男性、慢性壊死性肺アスペルギルス症、腎肝障害はなし
VRCZ200mgを12時間ごとで開始(初日と2日目は各300mg投与)
数日後から幻視の訴えあり、やや遅れて肝酵素の逸脱もあり
開始1週間後のトラフ値5.05mg/L
→内服へstep downする際に、肝障害および視覚障害が出現していたことから、測定結果報告を待たずにVRCZ150mgを1日2回服用へ減量。以後、症状は消失した
イトラコナゾール
薬物相互作用、胃内pH、食事などの影響を大きく受け、バイオアベイラビリティのばらつきが大きい薬剤である。血液内科や移植領域での使用を中心にTDMを考慮する。特定薬剤治療管理料の対象とはなっていないが、メーカーに依頼することで測定してもらうことができる。
〈References〉
1)Streetman DS,Nafziger AN,Destache CJ,et al:Individualized pharmacokinetic monitoring results in less aminoglycoside-associated nephrotoxicity and fewer associated costs.Pharmacotherapy.2001 Apr;21(4):443-51.
2)Francioli P,Ruch W,Stamboulian D:Treatment of streptococcal endocarditis with a single daily dose of ceftriaxone and netilmicin for 14 days:a prospective multicenter study.Clin Infect Dis.1995 Dec;21(6):1406-10.
3)Nicolau DP,Freeman CD,Belliveau PP,et al:Experience with a once-daily aminoglycoside program administered to 2,184 adult patients.Antimicrob Agents Chemother.1995 Mar;39(3):650-5.
4)Chuck SK,Raber SR,Rodvold KA,et al:National survey of extended-interval aminoglycoside dosing.Clin Infect Dis.2000 Mar;30(3):433-9.
5)Dahlgren JG,Anderson ET,Hewitt WL:Gentamicin blood levels:a guide to nephrotoxicity.Antimicrob Agents Chemother.1975 Jul;8(1):58-62.
6)Burton ME,Shaw LM,Schentag JJ,et al: Applied Pharmacokinetics and Pharmacodynamics:Principles of Therapeutic Drug Monitoring,4th ed.,Lippincott Williams & Wilkins,2005.
7)Kubota T,Chiba K,Ishizaki T:Genotyping of S-mephenytoin 4′-hydroxylation in an extended Japanese population.Clin Pharmacol Ther.1996 Dec;60(6):661-6.
8)木村匡男・他:CYP2C19遺伝子解析結果からみたボリコナゾール血中濃度モニタリングの臨床的意義.Jpn J Antibiot.2010;63(3):255-64.
9)Johnson LB,Kauffman CA:Voriconazole:a new triazole antifungal agent.Clin Infect Dis.2003 Mar 1;36(5):630-7.
10)Purkins L,Wood N,Kleinermans D,et al:Effect of food on the pharmacokinetics of multiple-dose oral voriconazole.Br J Clin Pharmacol.2003 Dec;56 Suppl 1:17-23.
11)Ueda K,Nannya Y,Kumano K,et al:Monitoring trough concentration of voriconazole is important to ensure successful antifungal therapy and to avoid hepatic damage in patients with hematological disorders.Int J Hematol.2009 Jun;89(5):592-9.
12)Hamada Y,Seto Y,Yago K,et al:Investigation and threshold of optimum blood concentration of voriconazole:a descriptive statistical meta-analysis.J Infect Chemother.2012 Aug;18(4):501-7.
(了)