経口抗菌薬へのスイッチを再考する
今、経口抗菌薬を見直す意味
セファゾリンの供給停止問題は、一時的とはされているものの、日本の感染症診療に大きな影響を及ぼしています。この問題は、1種類の薬剤だけにとどまらず、他の静注抗菌薬の供給不安をも引き起こす事態になっています。
感染症診療における治療期間は、すべてがランダム化比較試験の成績に基づいて決定されてきたわけではありません。参考となる研究事実が乏しいため、慣習に基づいて数週間単位の抗菌薬投与が行われる事例が多くありました。近年、薬剤耐性菌対策としての抗菌薬適正使用の観点から、「治療失敗や再発・再燃などの不良な予後につながらない範囲で、投与期間をどれだけ短縮できるのか」が課題になっており、このため静注抗菌薬の使用期間に対するアプローチとして、短期間投与の長期間投与に対する非劣性を示した研究が増加しています。
静注抗菌薬の使用量を減らすもう一つの方法は、早めに経口抗菌薬へ変更 (スイッチ)することです。経口抗菌薬へのスイッチを早期から安全に行うことができれば、入院期間の短縮、患者の快適性の向上、点滴に関連した合併症の減少、静注抗菌薬の調整に関わる時間や薬剤コストの削減につながり、大きな利点があります[1]。
静注抗菌薬の使用量の適正化や、経口抗菌薬の有効利用も含めた治療の選択肢が増えることは、抗菌薬の供給問題に対して有効である可能性があります。抗菌薬の適正使用の観点から、米国感染症学会(Infectious Diseases Society of America; IDSA)ガイドラインでも静注抗菌薬から経口抗菌薬への適切なタイミングでの変更が推奨されています[2]。
セファゾリン問題を契機に、経口抗菌薬をよりうまく使うにはどうしたらよいのか、考えてみませんか?
どのような状況であれば静注抗菌薬を経口抗菌薬にスイッチできるか
治療開始後に静注抗菌薬から経口抗菌薬へのスイッチを考慮する場合、従来からよく知られた指標としてCOMS criteriaがあります(表1)。
| C | Clinical improvement observed 臨床症状が改善している |
|---|---|
| O | Oral route is not compromised 経口投与が嘔吐、吸収障害、飲食禁止、嚥下障害、意識障害、重度の下痢で妨げられることがなく、適切な経口抗菌薬の選択肢がある |
| M | Markers showing trend towards normal
|
| S | Specific indication/deep seated infection requiring prolonged iv therapy 静注抗菌薬の長期間治療が必要な疾患(感染性心内膜炎、髄膜炎、骨・関節の感染症)ではない |
そのほかにも複数の指標を検討した報告[3]がありますが、主に下記の指標を目安に経口抗菌薬へのスイッチが可能と判断されています。
- 臨床経過が順調に改善している。
- 血行動態が安定し、体温や呼吸数などのバイタルサインも落ち着いている。
- 採血上の感染に関連する指標が改善傾向である。
- 消化管機能が保たれ、経口抗菌薬の投与経路が確立されている。
- 静注抗菌薬の長期間治療を考慮すべき複雑性感染症ではない。
経口抗菌薬への変更をする時期については明確な指標はありませんが、治療開始後48-72時間での変更を、早期の変更ととらえている研究が多いです。
では、こうした指標を目の前の感染症治療にどのように適用すればよいのでしょうか。現在、肺炎、尿路感染症、腹腔内感染症といった感染症に対しては、非複雑性感染症であれば短期間治療が長期間治療に劣らないとする知見が増えてきています。「非複雑性」とは、治療を妨げる機能的・解剖学的・免疫学的異常がないという意味です。
経口抗菌薬の有効性を示した研究の数も増えています。一方で、実臨床での決断には様々な要素が関係し、エビデンスの適用が難しい場合もあります。臨床医が静注抗菌薬を経口抗菌薬にスイッチすることができない理由を調べた研究があり、主に3つの要素が挙げられています(表2)[4]。こうした要素に自覚的になり、自分の置かれた状況を振り返ってみることが、主体的に抗菌薬を変更できるための第一歩といえるでしょう。
- 患者の治療に対する不満や、医師が訴訟を恐れることが、静注抗菌薬を選択させる圧力になっている。
- 医療チームが階層構造であるゆえにdecision-makingが遅れる(上級医が決定に至るまで時間がかかる、経口薬スイッチが優先順位の低い決定事項であることも影響している)。
- 患者も医師も「静注抗菌薬のほうがとにかく良い」という“神話”を持っている。
どの感染症においても経口薬スイッチが可能であれば利点はあると思いますが、慣習的に長期間治療が行われてきた感染症こそ、早期の経口薬スイッチの利点が大きいです。実際に、以前は経口抗菌薬が使用されなかった感染症に対して、経口抗菌薬を使用した結果についての論文が増えてきています。ただ、今の段階では経口薬スイッチについて一般的によく用いられる指針はなく、現在集積している知見を念頭に、個別の事例ごとに考える必要があります。
ここではまず、使用できる経口抗菌薬のbioavailabilityについて論じます。次に、経口薬スイッチが可能な感染症について検討します。最後に、複雑性感染症に対する経口抗菌薬について分かってきたことを述べます。
経口抗菌薬のbioavailability
静注抗菌薬を経口抗菌薬に変更する際の問題の一つが、経口抗菌薬では薬剤ごとにbioavailabilityが異なることです。また、静注抗菌薬なら感染を悪化・再燃させにくいという強い思い込みがあるために、経口抗菌薬に変更する際に心理的な抵抗が生じることがあります。実際には、bioavailabilityに優れた経口抗菌薬であれば、静注抗菌薬同等の効果が期待できることが多いです。表3[5]にbioavailabilityを90%以上と60-90%の2パターンに分けて、抗微生物薬の投与例を記載します。
早期の経口抗菌薬への変更が検討された過去の研究においても、bioavailabilityに優れた薬剤を用いた研究が多いです。よって、まずは対象となる感染症が、これらの薬剤でカバーできるのか考えましょう。bioavailabilityの良好な抗微生物薬の薬物動態については、一般的に健常人での研究に基づくものが多いですが、罹患した状態の患者でも同等の値を示していた、とする報告もあります[6-9]。
次に、現在までの研究をもとに、どのような事例で経口抗菌薬への変更が試みられてきたかを確認してみましょう。
| 経口薬のbioavailability >90% | ||
|---|---|---|
| 抗菌薬 | 静注薬 | 経口薬 |
| フルオロキノロン | シプロフロキサシン: 400mg/回 12時間毎 |
シプロフロキサシン: 500mg/回 12時間毎 |
| レボフロキサシン: 500mg/回 24時間毎 |
レボフロキサシン: 500mg/回 24時間毎 |
|
| 本邦には静注製剤なし | モキシフロキサシン: 400mg/回 24時間毎 |
|
| 抗真菌薬 | 静注薬 | 経口薬 |
| アゾール | フルコナゾール: 100-200mg/回 24時間毎 |
フルコナゾール: 100-200mg/回 24時間毎 |
| ボリコナゾール: 200mg/回 24時間毎 |
ボリコナゾール: 200mg/回 24時間毎 |
|
| 経口薬のbioavailability 60-90% | ||
| 抗菌薬 | 静注薬 | 経口薬 |
| ペニシリン | アンピシリン: 2g/回 6時間毎 |
アモキシシリン: 500mg/回 8時間毎 |
| セフェム | セファゾリン: 2g/回 8時間毎 |
セファレキシン: 500mg/回 6時間毎 |
| リンコマイシン | クリンダマイシン: 600mg/回 8時間毎 |
クリンダマイシン: 300-450mg/回 6-8時間毎 |
| マクロライド | エリスロマイシン: 500-1000mg/回 6時間毎 |
エリスロマイシン: 500mg/回 6時間毎 |
経口薬スイッチができる感染症
特定の疾患については、ガイドラインで治療期間や選択する薬剤の記載があります。しかし、静注抗菌薬での治療を中心にしており、経口抗菌薬についての記載に乏しいです。この場合、個別のエビデンスについて、それが実際の患者に適用できるのかを見極める必要があります。具体的には、患者の免疫状態などのホストの状況、感染巣、原因菌が経口薬スイッチを行うに妥当かを考える必要があります。
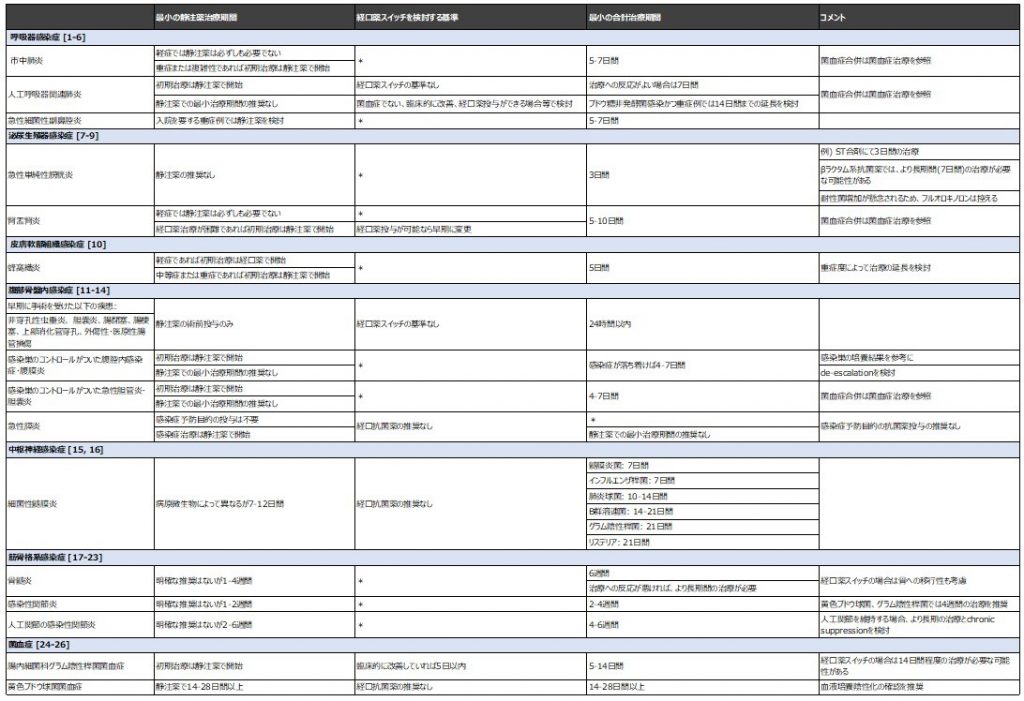
例えば、一般的に尿路へは各種の抗菌薬の移行性が良いため、尿路感染症は経口抗菌薬で治療できる代表的な疾患と思われます。ほかに肺炎、皮膚軟部組織感染症、腹腔内感染症なども経口薬スイッチを検討可能な疾患といえますが、十分なエビデンスがあるわけではありません。これらについては、表4に病態別の治療について記載したので参考にしてください。ただし、未だ根拠となる文献が少なく、議論の余地が大きい分野であることをご了承ください。
こうした疾患の中でも、特に菌血症の治療については、原因となる感染巣を踏まえて判断する必要があります。例えば、腸内細菌科グラム陰性桿菌(gram-negative rod; GNR)菌血症や腸球菌菌血症の場合、経口薬へのスイッチを検討した研究の多くは、免疫正常者の非複雑性の尿路感染症を取り上げています。最近の研究では、5日以内の早期に経口薬スイッチをした群と、静注抗菌薬を継続した群とで、死亡率・再発率に差がなかったとしています[10]。
また、未解決の課題として、腸内細菌科GNRによる感染症を治療する際の経口抗菌薬として、極めてbioavailabilityが高いフルオロキノロンやST合剤を使用するのか、βラクタム系抗菌薬でもよいのか、という問題があります[11]。感染症医の中でも意見が分かれるようです。先ほどのJAMA Internal Medicineの論文[10]でも、経口抗菌薬の種類別に差を示すことはできていません。βラクタム系抗菌薬の中にbioavailabilityの異なる薬剤が混在することも、混乱を招く原因になっています。フルオロキノロン・ST合剤と、βラクタム系抗菌薬の間で予後に差がないとする研究もあります。しかし、現状でこの問題に判断を下すには、十分に事実が集積していません[12]。βラクタム系抗菌薬を使用するのであれば、セファレキシン、アモキシシリン、アモキシシリン・クラブラン酸などのbioavailabilityの高い薬剤に限定するというのが一つの方法でしょう。経口抗菌薬を含めた適切な治療期間も、まだ検討が必要です。
腸内細菌科GNR菌血症や腸球菌菌血症を伴う感染症でも、疾患によっては早期に抗菌薬を経口薬に変更することが可能といえるかもしれません。なお、AmpC過剰産生菌や、ESBLなどの耐性菌に対しての経口抗菌薬の是非、P. aeruginosaなどのブドウ糖非発酵グラム陰性桿菌の感染症については研究が少なく、まだ今後の検討が必要です[13]。
グラム陽性菌、特に S. aureusの菌血症で経口抗菌薬への変更は可能なのでしょうか。IDSAガイドラインでは、カテーテル関連血流感染症(catheter-related bloodstream infection; CRBSI)や感染性心内膜炎(infective endocarditis; IE)など、特定の感染症について治療期間を定めていますが、一般的に長期間の静注抗菌薬の治療が想定されています。とはいえ、現実的には患者の状況によって、こうした感染症でも経口抗菌薬を検討しなければならない場面はあります。
欧州臨床微生物・感染症学会(European Society of Clinical Microbiology and Infectious Diseases; ESCMID)の会員を対象に、血流感染症でIDSAガイドラインがどの程度遵守されているのか調べた報告があります[14]。この報告では、専門家の1/4が治療後10日目以降で経口抗菌薬への変更を行うと回答しており、少数ですが治療開始後48-72時間以降での変更を考慮するという回答もあります。各国で事情は様々でしょうが、現場では意外に早期から経口抗菌薬にスイッチされている可能性があります。
現在、 S. aureus菌血症は静注抗菌薬での治療完遂が推奨される感染症であり、疾患の重症度を考えると治療適応の判断には慎重にならなければいけません。しかし、今後状況を限定すれば、経口抗菌薬に変更して治療を行える可能性はあるでしょう。
複雑性感染症における経口抗菌薬
そうした中、左心系IEに対する経口薬スイッチを検討した多施設ランダム化割付研究(POET trial)が2019年に発表されました[16]。経口抗菌薬群は、最低10日間の静注抗菌薬治療後に経口抗菌薬にスイッチするというもので、複合アウトカムでは両群間に差がありませんでした。この研究では原因菌にStreptococcusが多く、この結果を他の原因菌によるIEに容易に一般化できるものではありません。しかし、4週間以上の長期間治療を必要とすることが多い疾患なだけに、経口抗菌薬での治療という選択肢が増えることは重要であると思われます。
近年は、従来静注抗菌薬が治療の中心であった複雑性感染症においても、経口抗菌薬へのスイッチを検討した研究が増えてきています。IEに関しては、Al-omariらの総説によると、後ろ向きに経口抗菌薬の有効性を検討した研究がありますが、左心系と右心系の心内膜炎が区別されていないなど、現実への適用にはいくつか課題のある内容でした[15]。
同様に、経口薬スイッチの研究が増えてきた感染症に骨・関節の感染症があります。この領域においても、静注抗菌薬で4-6週間といった長期間の治療が行われる傾向がありますが、慢性骨髄炎のメタアナリシスでも、経口抗菌薬に対して静注抗菌薬の優位性は示されませんでした[17]。2019年に発表されたOVIVA trialは、骨・関節感染症に対する経口薬スイッチの非劣性を示した研究です[18]。被験者は、術後または保存的治療開始後7日以内に無作為化され、最低6週間まで経口抗菌薬または静注抗菌薬で治療されました。1年後までの経過観察を行い、結果は経口抗菌薬が静注抗菌薬に対して非劣性であり、カテーテル関連の合併症は経口抗菌薬群で少ないというものでした。こうした研究からは、従来静注抗菌薬で治療した疾患においても、経口薬スイッチが成功する場合があることが示唆されています。
まとめ
静注抗菌薬から経口抗菌薬へ変更する際の要点について述べてきました。この領域はまだまだ未解決な問題点が多く、安易な臨床応用を行うことは注意しなければいけません。患者の感染巣、原因菌、背景疾患などを考慮した上で経口抗菌薬の適応を決める必要があり、難しい判断を求められますが、今後多くの可能性を秘めた領域でもあります。静注抗菌薬の適正使用を意識しなければいけない今だからこそ、経口抗菌薬に目を向ける必要があるのではないでしょうか。
【Reference】
- Nathwani D, Lawson W, Dryden M, et al: Implementing criteria-based early switch/early discharge programmes: a European perspective. Clin Microbiol Infect. 2015 Sep; 21 Suppl 2: S47-55.
- 早川佳代子, 山元佳, 忽那賢志・他訳: 抗菌薬適正使用プログラムの実施: 米国感染症学会および米国医療疫学学会によるガイドライン. http://hica.jp/ASP/ASPguideline2016japanese.pdf
- Beique L, Zvonar R: Addressing Concerns about Changing the Route of Antimicrobial Administration from Intravenous to Oral in Adult Inpatients. Can J Hosp Pharm. 2015 Jul-Aug; 68(4): 318-26.
- Broom J, Broom A, Adams K, et al: What prevents the intravenous to oral antibiotic switch? A qualitative study of hospital doctors’ accounts of what influences their clinical practice. J Antimicrob Chemother. 2016 Aug; 71(8): 2295-9.
- Cyriac JM, James E: Switch over from intravenous to oral therapy: A concise overview. J Pharmacol Pharmacother. 2014 Apr; 5(2): 83-7.
- Rebuck JA, Fish DN, Abraham E: Pharmacokinetics of intravenous and oral levofloxacin in critically ill adults in a medical intensive care unit. Pharmacotherapy. 2002 Oct; 22(10): 1216-25.
- Chin TW, Vandenbroucke A, Fong IW: Pharmacokinetics of trimethoprim-sulfamethoxazole in critically ill and non-critically ill AIDS patients. Antimicrob Agents Chemother. 1995 Jan; 39(1): 28-33.
- Shaffer JL, Kershaw A, Houston JB: Disposition of metronidazole and its effects on sulphasalazine metabolism in patients with inflammatory bowel disease. Br J Clin Pharmacol. 1986 Apr; 21(4): 431-5.
- Pelz RK, Lipsett PA, Swoboda SM, et al: Enteral fluconazole is well absorbed in critically ill surgical patients. Surgery. 2002 May; 131(5): 534-40.
- Tamma PD, Conley AT, Cosgrove SE, et al; Antibacterial Resistance Leadership Group: Association of 30-Day Mortality With Oral Step-Down vs Continued Intravenous Therapy in Patients Hospitalized With Enterobacteriaceae Bacteremia. JAMA Intern Med. 2019; 179(3): 316-23.
- Mogle BT, Beccari MV, Steele JM, et al: Clinical considerations for oral beta-lactams as step-down therapy for Enterobacteriaceae bloodstream infections. Expert Opin Pharmacother. 2019 Jun; 20(8): 903-7.
- Mercuro NJ, Stogsdill P, Wungwattana M: Retrospective analysis comparing oral stepdown therapy for enterobacteriaceae bloodstream infections: fluoroquinolones versus β-lactams. Int J Antimicrob Agents. 2018 May; 51(5): 687-92.
- Yan LZ, Herrington JD: Outcomes of hospitalized neutropenic oncology patients with Pseudomonas aeruginosa bloodstream infections: focus on oral fluoroquinolone conversion. J Oncol Pharm Pract. 2016 Aug; 22(4): 584-90.
- Diallo K, Thilly N, Luc A, et al; ESGAP, ESGBIS: Management of bloodstream infections by infection specialists: an international ESCMID cross-sectional survey. Int J Antimicrob Agents. 2018 May; 51(5): 794-8.
- Al-Omari A, Cameron DW, Lee C, et al: Oral antibiotic therapy for the treatment of infective endocarditis: a systematic review. BMC Infect Dis. 2014 Mar 13; 14: 140.
- Iversen K, Ihlemann N, Gill SU, et al: Partial Oral versus Intravenous Antibiotic Treatment of Endocarditis. N Engl J Med. 2019 Jan 31; 380(5): 415-24.
- Conterno LO, Turchi MD: Antibiotics for treating chronic osteomyelitis in adults. Cochrane Database Syst Rev. 2013 Sep 6; (9): CD004439.
- Li HK, Rombach I, Zambellas R, et al; OVIVA Trial Collaborators: Oral versus Intravenous Antibiotics for Bone and Joint Infection. N Engl J Med. 2019 Jan 31; 380(5): 425-36.