臨床医のための診療ガイドライン「COVID-19薬物療法に関するRapid/Living recommendations」の読み方(1)
はじめに
COVID-19が世に現れて1年以上がたちました。COVID-19に関する情報洪水の中で、日本救急医学会・日本集中治療医学会が、診療ガイドライン「COVID-19薬物療法に関するRapid/Living recommendations」[1]を発行し、不定期でアップデートしているのはご存じでしょうか。この診療ガイドラインは、日本版敗血症診療ガイドライン2020特別委員会COVID-19対策タスクフォースが、「日本版敗血症診療ガイドライン2020(J-SSCG2020)特別編」として出しているものです。
特筆すべきポイントは、2つ。
1つ目は、常にアップデートを繰り返すlivingガイドラインであること。2020年9月9日に第1版が発行されて以降、本稿執筆の2月時点で2021年1月29日の第3.0版が最新となっていました(その後校正段階の3月時点で早速第3.1版にマイナーアップデートがなされ、更新が続いています)。
そして2つ目は、GRADEシステムにきちんと準拠して作成されており、GRADEを理解している人にとっては読みやすい構成になっていること。GRADEシステムとは、2004年のBritish Medical Journal(BMJ)に発表されて以来、WHOや世界的なガイドライン作成の手法として取り入られてきている体系です[2、3]。一方で、ガイドライン作成等に関わることがない人にとっては、GRADEの洗練された構成は取っ付きにくく、せっかくアップデートが頻繁でも、患者を前にした多忙な臨床医が読み込んで意思決定に十二分に生かせるかというと、なかなか難しい面もあるように思います。
そこで本稿は、「GRADEシステムに準拠した診療ガイドラインをざっくりと読んで、それが意味するところをくみ取れるようになれること」を目指して、3つの視点からまとめてみようと思います。さらに、世界で初めてCOVID-19治療薬として承認されたレムデシビルのエビデンスを具体例として、第3.0版 が発行された時点での位置付けについてお示ししてみます。3回に分けて掲載しますが、なかなか込み入っているので、各回を行ったり来たりしながら読んでみてください。
| 本稿の対象読者: 診療ガイドライン「COVID-19薬物療法に関するRapid/Living recommendations」第3.0版(本編:全35ページ[1]、付録:全115ページ[4])のCQ-1ファビピラビル、CQ-2レムデシビル、CQ-4ステロイドの項を中心に、GRADEシステムに準拠した診療ガイドラインを読めるようになりたい医療従事者 本稿を読み終わった後、答えられるようになりたい質問: 「重症だからとか、承認された治療薬があるからという理由のみで、COVID-19と診断された人全員に対してルーチンにレムデシビルを投与するのは、適正な医療行為か?」と問われたら、どう答えますか? 本稿を読むにあたってのお願い: 本稿は、診療ガイドラインの読み方に主眼を置くものであり、“最新の”診療ガイドライン内容を紹介することを意図しておりません。執筆時点で最新であった第3.0版を参照し解説していますが、本ガイドラインはRapid/Living recommendationsであり、常に更新されていきます。最新版は、https://www.jsicm.org/news/J-SSCG2020_COVID19.html でご確認ください。 |
本稿の目次
■視点1:どのくらい推奨されるのか?(第1回掲載)
■視点2:効果はどのくらいなのか?(第1回掲載)
■視点3:エビデンスはどのくらい確実なのか?(第2回掲載)
■COVID-19治療薬レムデシビルのエビデンス(第3回掲載)
視点1:どのくらい推奨されるのか?
推奨度は2段階しかなくなった!?
COVID-19の薬物治療に関する推奨文の例を表1にまとめてみました[1、4]。GRADEシステムでは、推奨の方向性としては「行う」「行わない」の2つがあります。そして、それぞれの方向性に関する推奨度は、「強く推奨する(=1)」「弱く推奨する(=2)」の2段階のみです[5-7]。従来は様々なガイドラインごとに様々なグレードや推奨文が乱立していましたが、GRADEシステムでの推奨度はシンプルです。
推奨度は、数字の1または2でも表されます。数字の後ろに付いているアルファベット(A-D)はエビデンスの確実性を表しますが、これは推奨度とは独立していることに注意が必要です。例えば、CQ-4の重症度別のステロイド投与に関する推奨度は、エビデンスの確実性はAやBと差があるものの、推奨度は同じ「強い推奨」となっています。「酸素を投与していない患者には投与しない」「酸素を投与している患者には投与する」ことが、それぞれ強く推奨されているというわけです。
表1 clinical question(CQ)と推奨(抜粋)| CQ-1 COVID-19患者にファビピラビルを投与するか? | 酸素投与を必要としない軽症患者にファビピラビルの投与を弱く推奨する(弱い推奨/低の確実性のエビデンス:GRADE 2C) |
| 酸素投与/入院加療を必要とする中等症患者、ならびに人工呼吸器管理/集中治療を必要とする重症患者に対するファビピラビルの投与については、現時点では推奨を提示しない(no recommendation) | |
| CQ-2 COVID-19患者にレムデシビルを投与するか? |
酸素投与を必要としない軽症患者に対するレムデシビルの投与については、現時点では推奨を提示しない(no recommendation) |
| 酸素投与/入院加療を必要とする中等症患者にレムデシビルの投与を弱く推奨する(弱い推奨/中の確実性のエビデンス:GRADE 2B) | |
| 人工呼吸器管理/集中治療を必要とする重症患者にレムデシビルを投与しないことを弱く推奨する(弱い推奨/中の確実性のエビデンス:GRADE 2B) | |
| CQ-4 COVID-19患者にステロイドを投与するか? | 酸素投与を必要としない軽症患者にステロイドを投与しないことを強く推奨する(強い推奨/中の確実性のエビデンス:GRADE 1B) |
| 酸素投与/入院加療を必要とする中等症患者、ならびに人工呼吸器管理/集中治療を必要とする重症患者にステロイドを投与することを強く推奨する(強い推奨/高の確実性のエビデンス:GRADE 1A) |
「弱い推奨」って、推奨されるの!? されないの!?
レムデシビルは、人工呼吸器管理/集中治療を必要とする重症患者に対しては、投与しないことを「弱く推奨」するとのことですが、これはどういうことでしょうか?
推奨の強さの定義とは、望ましい効果(益)が、望ましくない効果(害、負担、コスト)を上回る、あるいは下回る確信が、強いか弱いかを示すもの、だそうです。もう少し分かりやすく言い換えると、「強い推奨」では、原則として患者のほぼ全員が推奨される行動を希望し、医師はほぼ全員に対して実施することになります。一方、「弱い推奨」では、その状況にある患者のうち多くは希望するが希望しない人もいるため、医師は個別の状況や患者背景、価値観、意向を考慮することになります[1、5-7]。
「弱い推奨」という表現は、「条件付き」(conditional)、「裁量的」(discretionary)、「限定的」(qualified)などと表現されることもあります[5-7]。したがって 、先ほどの人工呼吸器管理/集中治療を必要とする重症患者に対して投与しないことを「弱く推奨」する、というのは、 レムデシビルは「多くの場合は投与しないが、状況によっては投与する」ことが勧められる、というわけです。
視点2:効果はどのくらいなのか?
推奨度の意味が分かったところで、臨床医が気になるのは研究の「結果」(results)の部分、すなわち「どのくらい効果があるのか」だと思います。効果(益や害)を説明するときに、どういうアウトカムが何%の確率でどうなるのか、具体的な数字をもって説明できると分かりやすいです。
基本です、効果推定値の理解!
臨床研究の結果である益や害は、対照群と介入群を比較するかたちで、オッズ比、リスク比、ハザード比、リスク差、治療必要数などで示されます。個別の研究では、これらを総称して「効果指標」(effect measure)と呼びますが、複数の研究を統合するシステマティックレビューでは「効果推定値」(estimate of effect)と呼びます[7]。2群を比較する効果推定値(効果指標)は、比(=相対評価)によるものと、差(=絶対評価)によるものの2種類に分けることができます[7]。
フォレストプロットとGRADEエビデンスプロファイル
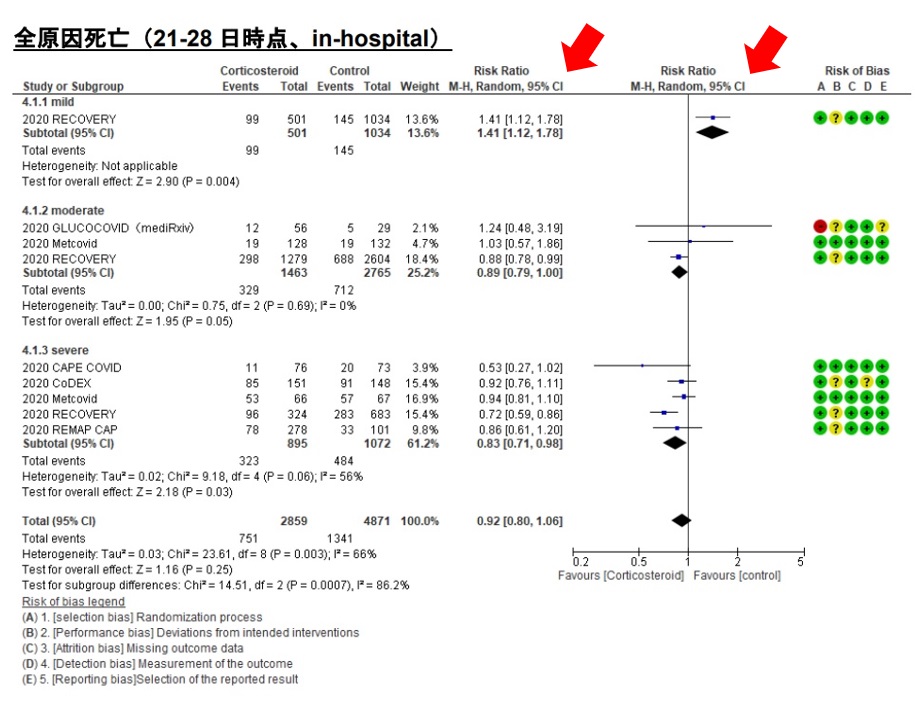
具体例として、CQ-4のステロイド投与による全原因死亡に関する結果部分を図に引用してみましょう[1、4]。効果推定値は、フォレストプロットでは比(リスク比)のみで示されています(図1)。また、GRADEエビデンスプロファイルの効果の項目では、相対=リスク比(risk ratio;RR)と絶対=リスク差(risk difference;RD)の両方で示されていることが分かります(図2)。
ベースラインリスクを何%低下させるか(相対効果)
比(RR)をみると、軽症患者ではステロイド投与により死亡率が1.41倍に増加しています。一方、中等症・重症患者ではそれぞれ0.89倍、0.83倍に減少しています。これは、1-RRを計算して、1-0.89=0.11(11%)、1-0.83=0.17(17%)、それぞれ死亡率を低下させたことを意味します。この1-RRは、ベースラインリスクからの相対リスク減少(relative risk reduction;RRR)といいます。いわゆる「ワクチンの有効率が95%」などというのは、「ベースライン発症率からのRRR」として効果を表現したものになります[8]。
ベースラインリスクを何%低下させるか(絶対効果)
ところで、ベースラインリスクと言いましたが、これは対照群のイベント発生率(ここでは死亡率)として示されています。中等症・重症患者ではそれぞれ25.8%、45.1%です。この死亡率がステロイド投与によって22.5%、36.1%に減っていますが、この減り幅こそがRDです。これをそのまま計算すると、25.8-22.5=3.3%、45.1-36.1=9%となりますが、統計的に推定した結果、2.8%(95%CI:5.4-0)、7.7%(95%CI:13.1-0.9)と示されています(図2では%ではなく1000人当たりの数値が示されている)。
中等症患者と重症患者に対するステロイド投与の効果は、RRでみると0.89、0.83とほぼ同等でしたが、イベント発生率、つまり死亡率が低い集団=中等症への介入の方が、絶対効果は小さくなることが見て取れます。なお、追跡期間が短くイベント発生率が十分でないと、やはりRDは小さくなりますよね。本ガイドラインでは、入手可能な限り28日後のアウトカムとしたと記載されています。
比(RR)なのか差(RD)なのかを意識しよう
というわけで、RRとRDは両方とも%表示が可能ですが、見ている視点が違うということを意識しておかないと、こんがらがってしまいます。
1人のイベントを減らすために何人に介入を行う必要があるか(絶対効果)
リスク差(RD)は、絶対リスク減少(absolute risk reduction;ARR)とも呼ばれます。このRD(ARR)の逆数として求められるのが、治療必要数(number needed to treat;NNT)です。例えば、死亡率を10%減らせるなら、1/0.1(あるいは100%/10%と計算しても同じ)、つまり10人治療すればそのうちの1人の死亡を減らせるということです。
中等症・重症で、それぞれ2.8%、7.7%死亡率を減らせるということは、NNTは1/0.028(=100/2.8)=35.7、1/0.077(=100/7.7)=13.0です。強く推奨される確固たる治療効果といえども、これくらいなんですね。ベッドサイドで臨床医あるいは患者自身が「経験」として感じ取ることはできないレベルの効果だと思いますが、だからこそ臨床研究によるエビデンスの構築が重要です。
(文献1、4より引用。本引用は執筆時点の第3.0版に基づいたものです。本ガイドラインはRapid/Living recommendationsであり常に改訂されていますので、最新版は、https://www.jsicm.org/news/J-SSCG2020_COVID19.htmlでご確認ください。)
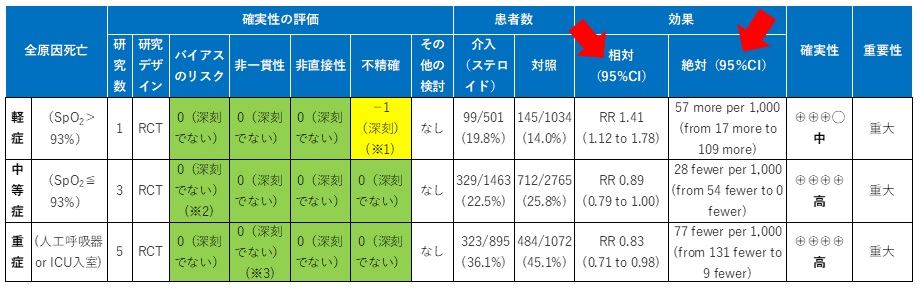
(重症度別3群の結果の表から、全原因死亡に関する部分をまとめて示す)
最適情報量は、α0.05、 検出力80%として計算
※1 95%CI が臨床的に意味のある閾値(RR=1.25)をまたぐ。
※2 GLUCOCOVIDは割付方法が一部無作為ではないがサンプルサイズが非常に小さく(n=85、重み=3%)、影響は与えないと判断した。
※3 I2値が66%と高いが、これはRECOVERYのサンプルサイズが大きいことに依存していると考える。コクランQ検定においてP<0.05である。
(文献1、4より引用。本引用は執筆時点の第3.0版に基づいたものです。本ガイドラインはRapid/Living recommendationsであり常に改訂されていますので、最新版は、https://www.jsicm.org/news/J-SSCG2020_COVID19.htmlでご確認ください。)
ガイドラインにP値が出てこないのはなぜ?
先ほど「統計的に推定」という言い方をしましたが、図1、2には慣れ親しんだ(?)P値(p<0.05で有意差あり)という記載が出てきません。なぜでしょうか?
有意差とは、2群を比較したときに「偶然ではない、統計学的に意味のある差があること」です。検定で用いられる統計量がP値で、推定で用いられるのが95%信頼区間(95%CI)というわけですが、P値の欠点として具体的にどのくらいの違いがあるのか分からない点が挙げられます。一方、これまで示してきたように、点推定値と95%CIを使うと、効果がどのくらいあるのかが数値で示せるのです。
95%CIとは、同じ調査を100回行った場合に、95回は得られた信頼区間の中に母平均(母集団における平均)が含まれている、という意味です。そして、95%CIがRRでは1、RDでは0をまたいでいなければ、「有意差あり」と判断できます。このとき、5%は間違っている可能性がありますが、有意水準を5%として有意差ありと判定しているわけです。
どのくらいの効果なら「大きな効果」ととらえるのか?
さて、臨床医としては、統計的に有意差ありと分かったところで、臨床的に意味のある「大きな」効果なのかが知りたくなります。とはいえ、どのくらいなら「大きい」としてよいのか、数字のとらえ方は人それぞれかもしれません。
本ガイドラインの解説の中には、アウトカム全般における「正味の効果推定値」(net effect estimate)の算出について説明が記載されています。また、計算された効果の大きさをどのくらいなら「大きい」ととらえるかについて、パネル委員会が合議で決定した表が掲載されています(表2)[1]。これをみると、リスク差20.1%以上(NNTで言えば5以下)なら「大きな効果」などと記載されており、結果を解釈するときの参考になります。
表2 正味の効果推定値(1000人当たりのリスク差)の大きさの判断閾値| 0-10人 (0-1%) | 11-30人 (1.1-3%) | 31-100人 (3.1-10%) | 101-200人 (10.1-20%) | 201人以上 (20.1%以上) |
| わからない | わずかな効果 | 小さな効果 | 中程度の効果 | 大きな効果 |
次回へ続く……
今回は、GRADEシステムでまとめられたガイドライン「COVID-19薬物療法に関するRapid/Living recommendations」を読むための2つの視点(視点1:推奨度、視点2:効果推定値のとらえ方)についてお話ししました。次回は、「視点3:エビデンスはどのくらい確実なのか?」という点を考えてみたいと思います。
注意1:本稿は、2020年2月末日時点での情報を主体として、限られたガイドライン作成の経験なども踏まえて個人的に作成したものです。GRADEシステムについては、GRADE working groupの最新情報(執筆時点では2013/10版)[9]を確認してください。
https://gdt.gradepro.org/app/handbook/handbook.html
注意2:本ガイドラインはRapid/Living recommendationsなので、本稿記載のエビデンス・内容は比較的早期に古くなり、改訂に伴い常に更新されます。この点に十分注意し、最新版をご確認ください。
https://www.jsicm.org/news/J-SSCG2020_COVID19.html
【References】
1)日本版敗血症診療ガイドライン2020特別委員会COVID-19 対策タスクフォース: 日本版敗血症診療ガイドライン2020(J-SSCG2020)特別編 COVID-19薬物療法に関するRapid/Living recommendations第3.0版, 2021/1/29.
https://www.jsicm.org/news/upload/J-SSCG2020_COVID-19_1_ver.3.0.0.pdf(本稿掲載の3.0版は執筆時点のもので旧版です。最新版は、https://www.jsicm.org/news/J-SSCG2020_COVID19.htmlでご確認ください。)
2)Atkins D, Best D, Briss PA, et al; GRADE working group: Grading quality of evidence and strength of recommendations. BMJ. 2004 Jun 19; 328(7454): 1490.
3)Guyatt GH, Oxman AD, Kunz R, et al; Going from evidence to recommendations. BMJ. 2008 May 10; 336(7652): 1049-51.
4)日本版敗血症診療ガイドライン2020特別委員会COVID-19 対策タスクフォース: 日本版敗血症診療ガイドライン2020(J-SSCG2020)特別編 COVID-19薬物療法に関するRapid/Living recommendations第3.0版 付録, 2021/1/29.
https://www.jsicm.org/news/upload/J-SSCG2020_COVID-19_2_ver.3.0.0.pdf(本稿掲載の3.0版は執筆時点のもので旧版です。最新版は、https://www.jsicm.org/news/J-SSCG2020_COVID19.htmlでご確認ください。)
5)Minds診療ガイドライン作成マニュアル編集委員会(編): Minds 診療ガイドライン作成マニュアル2020 ver.3.0,日本医療機能評価機構, 2021.
https://minds.jcqhc.or.jp/s/manual_2020_3_0
6)相原守夫: 診療ガイドラインのためのGRADEシステム, 第3版, 中外医学社, 2018.
7)豊島義博, 南郷里奈, 蓮池 聡(編): 学びなおしEBM―GRADEアプローチ時代の臨床論文の読みかた, クインテッセンス出版, 2015.
8)忽那賢志: 効果は? 安全性は? 新型コロナワクチンについて知っておきたいこと Q&Aで医師が解説(追記あり), Yahoo!ニュース 個人(2021/1/20).
9)Schünemann H, Brożek J, Guyatt G, et al: Handbook for grading the quality of evidence and the strength of recommendations using the GRADE approach. Updated October 2013.
https://gdt.gradepro.org/app/handbook/handbook.html